特集記事
インプラント型電子メディカルデバイスへのALD(原子層堆積)法による生体適合膜封止
PICOSUN JAPAN(株) 八尋 大輔

1. 緒言
エレクトロニクス技術の発展に伴い、電子デバイスを体内に埋め込むことで、新しい形の医療を実現しようというトレンドが近年ますますさかんになっている。無線通信技術やワイヤレス充電技術の進展著しい今日、体内で半永久的に駆動する電子デバイスは、もはや夢物語ではない。そこで問題になるのが、いかにしてデバイスを体内の腐食環境から守るか、また逆に、デバイスが含有する有害物質をいかにして体内に漏洩させないかという封止技術である。
この課題に対し、ALD(Atomic Layer Deposition:原子層堆積)という成膜技術により、新しい提案がなされている。本稿ではインプラント型電子メディカルデバイス(以下インプラントデバイス)封止の基本、ALD技術の特徴、及びALDによるインプラントデバイス封止技術についての最新の研究を述べる。
2. インプラントデバイス封止の課題
インプラントデバイスの種類は、心臓ペースメーカー、人工内耳、人工網膜(図1)など多岐にわたる。

図1 眼内圧測定センサ付コンタクトレンズ
(SENSIMED Triggerfish®)
医療用製品に関する国際規格であるISO10993において、メディカルデバイス全般では、人体との接触箇所(皮膚・粘膜・血液・骨など)や期間(24時間以下、30日以下、半永久的)などの区分があるが、本稿では半永久的なインプラント製品に絞って記述する。
インプラントデバイス封止材に必要とされる主な機能は以下の通りである。
① 生体適合性
生体適合性はインプラント材料にとって最重要事項である。人体に対して発がん性など有害な影響をもたらす材質は言うまでもなく不可であるが、一口に「生体適合性がある」と言っても様々な種類がある。例えばチタン合金のように反応性自体が乏しいもの、ハイドロキシアパタイトのように骨成長などの有益な反応をするもの、事前に患者から採取した細胞をin vitroで培養した再移植片などがあるが、これらは一括りに「生体適合性があれば何にでも使える」ということではない。目的とするアプリケーションに沿った適合性を持つ材料を選ぶ必要がある。
② 耐腐食性
生体内は恒常的に37℃近傍で血液や塩水などの体液に曝される腐食環境であり、インプラントデバイスの封止材はその環境下で十年以上の長期間腐食に耐える材質であることを要求される。
③ 気密封止性
電子デバイスはヒ化ガリウム、銅、鉛など毒性のある物質を含むことが多い。これらがデバイスから漏洩しないような材質で封止する必要がある。また、水蒸気の浸透によってデバイス内部の湿度が上がって結露し、イオンマイグレーションによる不具合の原因になることを防ぐため、シリコーン樹脂やエポキシ樹脂など、水蒸気が透過する材質も不適である。
④ 拡散バリア性
固体内で原子が移動する現象は拡散として知られている。封止材自体に気密性があったとしても、その表面に拡散してきた物質が人体へのコンタミとなる可能性があるため、拡散防止性能のある材質であることが望ましい。
⑤ 殺菌方法への耐久性
医療機器は清浄でなければならないため、通常エチレンオキサイド、または蒸気による滅菌が行われる。これらに対する耐久性が必要である。
⑥ デバイスとの密着性
封止材とデバイス表面との密着性が悪いと早期に剥離してしまい、剥離部分に体液の浸透が起こり、それに伴う腐食・有害物質の流出が起こる。そのため、長期にわたり剥離の起きない強固な密着性が必要である。
⑦ 製造工程における制約
製造がクリーンルームで行われる場合、クリーン環境を汚染する可能性のある材料は制限されることがある。例えばシリコーン樹脂やエポキシ樹脂は残存揮発性化合物による汚染、ステンレススチール等は金属汚染の問題がある。またバイオ材料には耐熱性が限定される材料が多く、封止に極端な高温を要求する工程は採用できないこともある。
インプラント材料は大きく、金属・高分子・セラミックの三種類がある。一般に金属は強度・靭性が高く機械加工しやすいが、導電しやすく腐食しやすいため通常はコーティングが必要であり、そのまま封止材としては用いられにくい。高分子はパリレンなど実用化されているものもあるが、無機材料に比べると経年で不安定である。セラミックは耐食性・耐熱性・絶縁性・経時での安定性に優れており硬度が高く、かつ次項で述べるALD技術のように、ナノレベルの成膜が可能であるため、インプラントデバイス封止材として有望視されている。
3. ALD技術概要
ALD(Atomic Layer Deposition)法は原子層堆積法と訳され、気相での反応で成膜をするプロセスである点は蒸着やCVDと同様だが、以下の点で他の成膜方法に比べて大きなメリットがある。
① 膜質が化学量論比に近く非常に緻密であり、ピンホールフ リー
② 素地への密着性が高い
③ 複雑な3D形状物やナノスケール表面(高ARトレンチ・ボ イド・ステップ)へも均一に成膜できる
④ 再現性の高いプロセスとして膜厚を厳密にコントロールで きる
⑤ 比較的低温での成膜が可能
アルミナ(Al2O3)を例にとると、ALDの成膜工程は次のように進行する。まず成膜対象物を入れたチャンバを真空(大凡<1hPa程度)にし、一つ目の原材料(プリカーサと呼ばれる)TMA(トリメチルアルミニウム、(CH3)3Al)ガスをチャンバに導入(パルス)する。TMAは表面のOH基に解離吸着し、この時副生成物としてメタン(CH4)が発生する。次に、窒素ガスでチャンバーを排気(パージ)し、余剰のTMAと副生成物のCH4をチャンバーから除去する。続いて二つ目の原材料H2Oをチャンバーに導入することで、表面を酸化させメタンを飛ばす。最後に再度窒素ガスで排気する。この4ステップを1サイクルとカウントする(図2)。
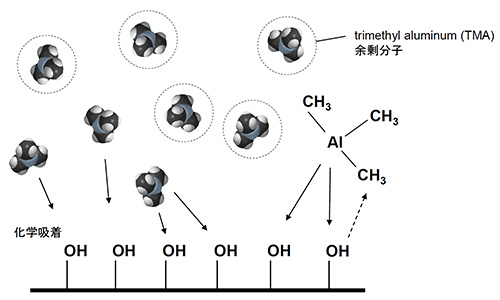
1.TMA(Trimetyl Aluminium、(CH3)3Al)分子が基板表面の-OH基と反応・吸着
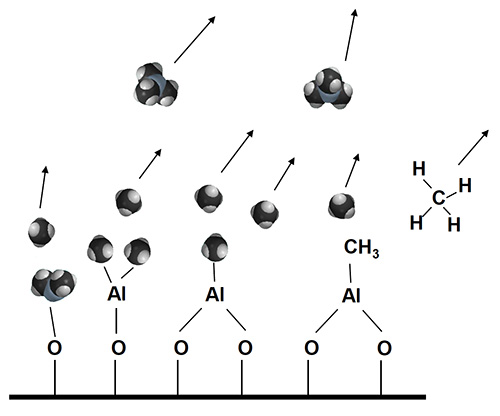
2.余剰TMA分子と副生成物のメタン分子CH4を窒素ガスパージで排出
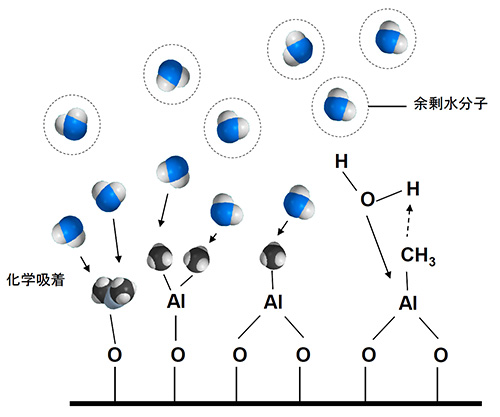
3.水分子H2OがTMA分子と反応・吸着
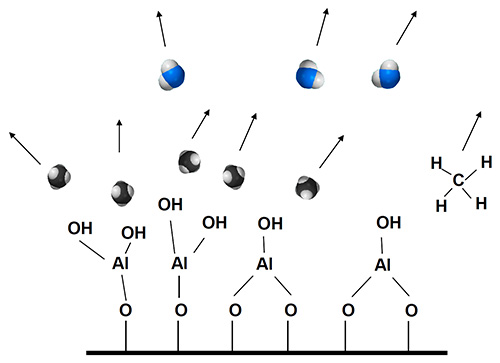
4.余剰水分子と副生成物メタン分子を窒素ガスパージで排出
図2 ALDプロセス図解
膜厚はこのALDサイクルを繰り返すことで増やすことができ、一般的には一度の成膜で数百〜数千サイクルを行う。
ALD膜は対象物表面と共有結合するため密着性は非常に高い。また各パルスでは、対象物表面にプリカーサ分子が吸着できるサイトがなくなった段階で反応が終了するため、自己制御的に1サイクルで1分子層が堆積される。従って、厳密な膜厚のコントロール(1分子層≒1Å=0.1nm)が可能で、化学量論比に近い緻密な膜ができる。そのため数〜数十nm程度で十分な性能を発揮できる場合も多く、デバイスを極力小型化したい場合にも有効である。理論上、十分な反応時間が確保されれば全ての表面にプリカーサ分子が吸着するため、剣山型神経電極のような高アスペクト比表面へも均一に成膜可能であり、複雑な構造物をむらなく膜封止できる。成膜温度は材料によるが、たとえばAl2O3では一般的に50℃〜300℃程度であり、熱ストレスに弱い材料を使用する場合にも比較的使いやすい。
ALD法にて成膜可能な材料は、研究段階まで含めれば非常に多岐にわたるが、一般的なものとしてはAl2O3、TiO2、ZrO2などの酸化物、TiN、TaNなどの窒化物、Pt、Irなどの金属が挙げられる。半導体のhigh-k絶縁膜や拡散バリア層、MEMSの保護膜などには既に幅広く使用されており、性質上、CVDやめっきなどで性能を達成できない高アスペクト比・超薄膜アプリケーションに強みがある技術である。昨今海外では、薬剤ナノ・マイクロパーティクルをコーティングし徐放性をもたせるドラッグデリバリーシステムや、本稿で紹介するインプラントデバイスの膜封止など、バイオ・メディカル分野でのALD技術の応用が広がっている。
4. ALD技術によるインプラントコーティング評価
バイオマテリアルとしては金属・セラミック・高分子材料が用途に応じて使われるが、3項に挙げた特色のため、近年ALDセラミック膜による封止の研究が進んでいる。一口にALDといっても、材料によってその特性は様々である。250℃にて各種材料を20nmALD成膜した場合の評価を表1に示す(試験条件の詳細は本項末尾の脚注を参照)。
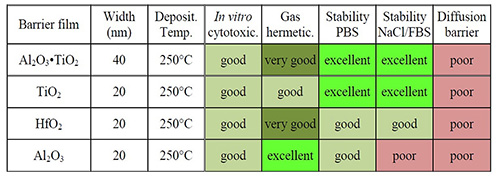
表1 ALD成膜の細胞毒性・気密封止性・耐食性など評価(Herrera, 2016, p.119)
Al2O3、HfO2、TiO2、Al2O3・TiO2のいずれのフィルムもISO10993-5に定める試験では細胞毒性がないことが確認された。Al2O3はPBSに対する耐食性は良好で気密封止性は非常に優れているが、塩水に対する耐食性は悪い。TiO2は耐食性ではPBS・塩水いずれにも非常に優れているが、気密封止性はAl2O3に劣る。HfO2はPBS・塩水に対し良好な耐食性と非常に優れた気密封止性をもつが、総合的な評価では、表1に示すとおりAl2O3・TiO2の複合膜が最も良好な結果を示した。拡散バリア性はAl2O3・TiO2いずれも満足できるレベルではないが、一般的に拡散バリア膜としてはTiNやTaNが使われるため、材料の検討で今後クリアされる問題であろう。
ALD膜は複数の膜材料を組み合わせて積層していくナノラミネート(図3)という手法も一般的であり、材料単体では発揮できない性能をもたせることもできる。
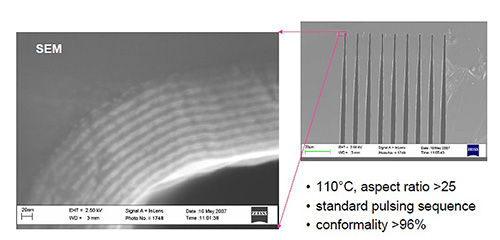
図3 ナノラミネート(Al2O3/TiO2)SEM写真
Picosun社(フィンランド)とBrown大学(米)の共同研究において、ALD法にて2種類の酸化物を10nmずつ100nmまでASICに積層コーティングさせ塩水中での耐久性を評価した試験では、際立って高い耐久性が確認された。成膜後継続して87℃の塩水に浸漬させ、ワイヤレスにて通信し漏電していないかを測定することで、水分がパッケージ内に侵入していないかをn=4にて評価した結果、最短寿命のもので168日、最長では250日以上(継続中)問題なく作動している。体内温度を37℃とし、温度が10℃上がれば反応性が2倍になるという考え方により、87℃での耐久性試験での耐久日数×25を実際に体内で使用した際の寿命とみなすと、14年から20年以上も耐えうるということになる。研究は端緒についたところであり、更なる寿命の延長やばらつきの低減などが今後期待される。
※脚注:In vitroでの細胞毒性はL929線維芽細胞を37℃血清中で24時間培養させ生存率を測定した。気密封止性はヘリウムの透過率を質量分析計にて測定。PBS耐食性は、KH2PO4を10.6mM、Na2HPO4・2H2Oを30.0mM、NaClを1.54M含む10倍PBS溶液を、抵抗率18.2MΩ・cmの水で希釈し、54℃〜60℃の範囲に昇温した液中に浸漬させ、8週間経過後の膜の減少量を観察した。塩水耐食性はNaCl0.9%に10vol%ウシ胎児血清を補充した生理食塩水37℃に4週間浸漬させ、膜厚及び組成の変化を観察した。拡散バリア性は、被封止物のSi基板を厚み1.5μmのCu膜でPVDコーティングしたものに対して細胞毒性と同じ評価が行われた。
5. 結言
耐食性・密着性・気密性に優れ、体内で不活性なセラミック膜を対象物表面に均一に成膜できるALDは他の封止技術に比べて優位であり、特に小型化や緻密な付き回り性が必要とされるデバイスであると、ほとんど唯一の選択肢となり得る。インプラントデバイスでは対象者への負担を可能な限り低減するために、理論的に最も薄く成膜できるALDが広く注目を集めている。前項最後に述べたナノラミネートの試験については様々な材料や膜厚の組み合わせが考えられ、今後も非常に有望な選択肢として検討されることは間違いない。詳細については是非、当社へお問い合わせ願いたい。
<参考文献>
1)高原淳他編(2016)『表面・界面技術ハンドブック−材料創製・分析・ 評価の最新技術から先端産業への適用、環境配慮まで』西敏夫監 修、(株)エヌ・ティー・エス
2)田中順三・角田方衛・立石哲也編(2008)『バイオマテリアル−材料 と生体の相互作用』堂山昌男他監修、(株)内田老鶴圃
3)牧野博之他(2012)『半導体LSI技術』共立出版(株)
4)Dennis Fitzpatrick(2016)『インプラント型電子メディカルデ バイス』中山淑他訳、(株)エヌ・ティー・エス
5)Joonsoo Jeong・Farah Laiwalla, Jihun Lee, Riina Ritasalo, Marko Pudas, Lawrence Larson, Vincent Leung, Arto Nurmikko(2018)
「Conformal Hermetic Sealing of Wireless Microelectronic Implantable Chiplets by Multilayered Atomic Layer Deposition(ALD)」
VILEY-VCH. (DOI: 10.1002/adfm.201806440.)
6)Jorge Mario Herrera Morales(2016)「Evaluating biocompatible barrier films as encapsulants of medical micro devices」(HAL archives-ouvertes.fr)
<https://tel. archives-ouvertes.fr/tel-01289295/document>(2018年12月20日アクセス確認)
7)Nanexa AB. 「PharmaShell® is Nanexa's revolutionary drug delivery system」
<http://www.nanexa.com/143-2/?lang=en>(2018年12月20日アクセス確認)